🧬 Evolución de la Biotecnología e Industria Farmacéutica
🔹 1. Introducción: de la síntesis química a la biotecnología
Durante gran parte del siglo XX, la industria farmacéutica estuvo dominada por una lógica fundamentalmente química: síntesis de moléculas, formulación de principios activos y validación clínica tradicional. El desarrollo de antibióticos, antiinflamatorios y tratamientos sintéticos marcó un antes y un después en la historia médica, consolidando un modelo basado en la repetibilidad, la farmacocinética y los grandes volúmenes.
Sin embargo, con la llegada de la biotecnología en las últimas décadas del siglo pasado, ese paradigma comenzó a transformarse. La posibilidad de utilizar organismos vivos, enzimas o procesos biológicos para crear terapias abrió un campo nuevo: los medicamentos biológicos. A diferencia de sus antecesores sintéticos, estos compuestos no se fabrican, se cultivan; no se diseñan, se expresan; y no se reproducen en masa, se personalizan.
Este salto desde lo químico hacia lo biológico no solo amplió el espectro terapéutico, sino que introdujo nuevos retos: regulación molecular más exigente, procesos de I+D más costosos, tecnologías analíticas avanzadas y la necesidad de integrar IA, automatización y ciencia de datos como parte del núcleo productivo.
Hoy, en pleno siglo XXI, la frontera entre lo biotecnológico, lo digital y lo farmacéutico se diluye. No hablamos ya de industria farmacéutica, sino de bioindustria inteligente, donde los datos, los algoritmos y la biología convergen para dar respuesta a una demanda global: terapias más seguras, más eficaces, más rápidas… y más sostenibles.
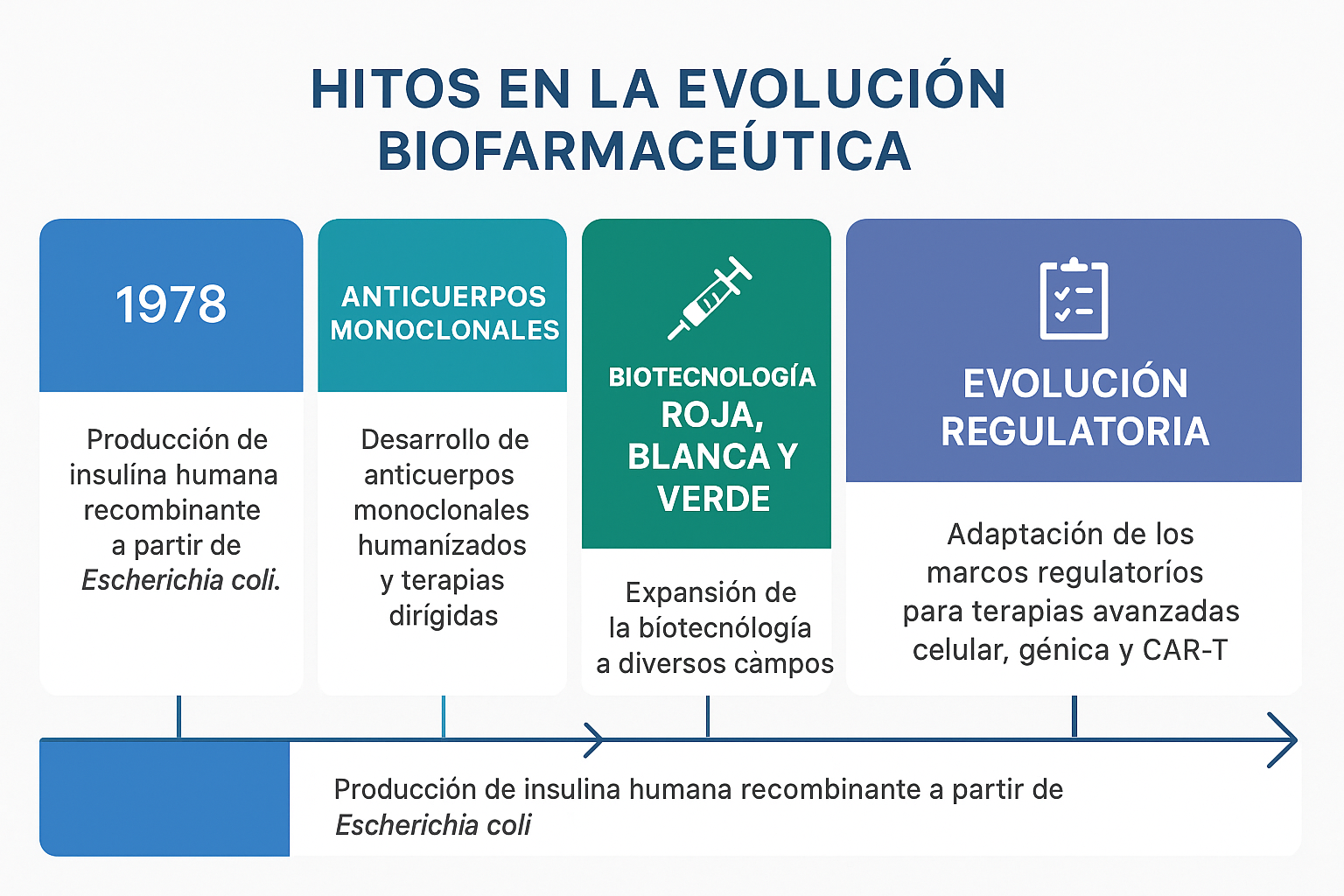
🔹 2. Hitos en la evolución biofarmacéutica
La biotecnología aplicada a la salud no surgió de golpe, sino a través de hitos científicos y tecnológicos que redefinieron la forma en que comprendemos, desarrollamos y producimos medicamentos.
🧬 1978: la primera insulina recombinante
El nacimiento oficial de la biotecnología farmacéutica moderna se sitúa en 1978, cuando se logró producir por primera vez insulina humana recombinante utilizando Escherichia coli. Fue un cambio de paradigma: por primera vez, un medicamento esencial se obtenía mediante ingeniería genética, no extracción animal.
Este logro marcó el comienzo de una nueva era en la producción de proteínas terapéuticas, y sentó las bases para el desarrollo de monoclonales, interferones, factores de crecimiento y vacunas modernas.
🧪 Anticuerpos monoclonales y terapias dirigidas
En los años 90 y 2000, la industria avanzó hacia los anticuerpos monoclonales humanizados y las terapias dirigidas, particularmente en oncología y enfermedades autoinmunes. Esta generación de fármacos ofrecía una selectividad sin precedentes, permitiendo atacar células diana con mayor precisión y menos efectos adversos.
💉 Vacunas de ARNm: de concepto a realidad
La pandemia de COVID-19 supuso otro gran hito: la validación masiva de tecnologías de ARN mensajero (ARNm). Lo que antes era experimental, se convirtió en una solución global en menos de un año.
Las plataformas de ARNm no solo han demostrado eficacia, sino que han abierto la puerta a una nueva lógica terapéutica: rápida adaptación, personalización y producción escalable. Su aplicación se extiende ya a vacunas terapéuticas contra el cáncer, VIH y enfermedades raras.
🔬 De biotecnología roja a biotecnología transversal
Actualmente distinguimos diferentes ramas dentro de la biotecnología aplicada:
- Roja: Salud humana y animal (fármacos, vacunas, terapias génicas)
- Blanca: Industria (biocatálisis, fermentación, biofabricación)
- Verde: Agrobiotecnología y mejora genética vegetal
Estas divisiones son cada vez más difusas, y la biofabricación se convierte en un nuevo eje transversal donde convergen IA, automatización y biología sintética.
🏛️ Regulación como facilitador del cambio
Un actor clave en este recorrido ha sido la evolución regulatoria. Tanto EMA como FDA han actualizado sus marcos para permitir la aprobación acelerada de terapias avanzadas, incluyendo productos biológicos, terapias celulares, CAR-T y tratamientos génicos.
Hoy, existen circuitos específicos como PRIority MEdicines (PRIME) de la EMA o Breakthrough Therapy Designation de la FDA que reconocen la necesidad de adaptar los ritmos regulatorios a la velocidad científica.
🔹 3. Convergencia tecnológica: IA, ómicas y automatización
La nueva era biofarmacéutica no se explica únicamente por avances biológicos. Lo que realmente está impulsando la innovación es la convergencia de disciplinas: biotecnología, ciencia de datos, robótica, inteligencia artificial, bioinformática y automatización industrial.
Estas tecnologías no solo optimizan fases individuales del ciclo de vida del medicamento, sino que permiten rediseñarlo por completo. Pasamos de un modelo lineal (descubrimiento → ensayo → comercialización) a un modelo adaptativo, iterativo y basado en datos vivos.
🤖 Inteligencia Artificial en descubrimiento de fármacos
La IA permite hoy analizar millones de combinaciones moleculares, predecir interacciones, simular ensayos virtuales y anticipar toxicidades antes de iniciar un estudio. Plataformas como DeepMind, Insilico Medicine o Recursion están redefiniendo los tiempos de I+D en el sector pharma.
🔬 Tecnologías ómicas: genómica, transcriptómica, proteómica
Gracias a la disminución del coste del análisis genético, se pueden incorporar perfiles multi-ómicos (ADN, ARN, proteínas, metabolitos) en el diseño terapéutico. Esto permite:
- Estratificación de pacientes para ensayos clínicos
- Identificación de biomarcadores terapéuticos
- Desarrollo de medicina personalizada
La IA actúa como interfaz entre estos datos masivos y la toma de decisiones farmacológicas.
🧫 Automatización en biofabricación y laboratorios
Laboratorios y CDMOs (organismos de manufactura por contrato) integran ya robótica, impresión 3D de tejidos, líneas automatizadas de formulación y sistemas de calidad predictiva. Esto reduce errores, acorta los tiempos de producción y mejora el cumplimiento regulatorio en entornos GMP.
📡 Ciencia de datos aplicada al acceso al mercado
Modelos predictivos permiten estimar el impacto real de un nuevo fármaco en salud pública, coste-efectividad, adopción clínica y comportamiento prescriptor. Esto facilita negociaciones de precio, decisiones de reembolso y estrategias de valor diferencial ante pagadores y gobiernos.
🔹 4. De la molécula al mercado: retos y oportunidades
La ciencia puede diseñar terapias extraordinarias. Pero sin un modelo que las lleve eficientemente desde el laboratorio hasta el paciente, su impacto será marginal. Entre la molécula y el mercado existen desafíos técnicos, regulatorios, económicos y logísticos que solo se superan con innovación integral y visión estratégica.
🧪 Costes crecientes y tiempos de desarrollo
Desarrollar un nuevo fármaco cuesta hoy entre 1.500 y 2.500 millones de euros, y puede tardar más de 10 años en llegar al mercado. Solo 1 de cada 10 moléculas que entra en fase clínica llega a ser aprobada.
La biotecnología reduce estos riesgos, pero también incrementa la complejidad regulatoria y científica, especialmente en terapias avanzadas, células modificadas o medicamentos de RNA.
🧬 Ensayos clínicos complejos y pacientes difíciles de reclutar
Los ensayos clínicos han pasado de diseños tradicionales a modelos adaptativos, multicéntricos y con criterios cada vez más estrictos.
- La IA está ayudando a seleccionar pacientes elegibles de forma más precisa.
- Se reducen costes y tiempos con ensayos descentralizados, basados en datos reales (RWD) y seguimiento digital.
🧾 Acceso al mercado y pricing basado en valor
La entrada de un medicamento en el mercado depende de la evaluación de valor terapéutico, impacto económico y negociación con sistemas sanitarios. Esto exige herramientas de farmacoeconomía, análisis coste-beneficio y resultados en salud (HTA).
La IA predictiva permite anticipar resultados poblacionales, optimizar dosificaciones, y mejorar el acceso en múltiples sistemas nacionales.
💊 Biosimilares, patentes y propiedad intelectual
La biotecnología también enfrenta el reto de la competencia tras la expiración de patentes. Los biosimilares exigen regulaciones específicas, ensayos de comparabilidad y estrategias de diferenciación no basadas solo en precio, sino en innovación de servicio, adherencia o acompañamiento clínico digital.
El recorrido desde una hipótesis molecular hasta una estrategia de mercado viable es cada vez más sofisticado. Pero quienes dominen el lenguaje de los datos, la regulación y el valor clínico–económico, tendrán una ventaja difícil de igualar.
🔹 5. España como hub biofarmacéutico: talento, innovación y visión internacional
España ha pasado de ser un actor intermedio en la cadena de valor farmacéutica a posicionarse como un epicentro europeo de innovación biofarmacéutica. Su fortaleza no reside únicamente en la capacidad productiva, sino en la confluencia entre talento científico, inversión en I+D, regulación favorable y ecosistemas colaborativos.
🧠 Talento científico y red de centros públicos punteros
El país cuenta con una red potente de hospitales universitarios, institutos de investigación y universidades biomédicas altamente conectadas con la industria. Programas como ITEMAS, CIBER, o la Plataforma ISCIII de Medicina de Precisión permiten integrar investigación clínica y traslacional en tiempo real.
🧬 Clústeres que impulsan la convergencia biotecnológica
Entidades como Biocat, CataloniaBio & HealthTech, ZINNAE, o el Parc Científic de Barcelona han creado entornos donde startups, laboratorios, universidades y administración pública colaboran en modelos de innovación abierta.
Cataluña y Navarra son regiones líderes en número de empresas biotech per cápita, y el País Vasco avanza con una estrategia propia en salud digital y bioproducción.
🧪 ASEBIO y Farmaindustria: visión estratégica y puente institucional
- ASEBIO (Asociación Española de Bioempresas) actúa como eje vertebrador del sector biotecnológico. Su papel en inversión, regulación, internacionalización y emprendimiento es decisivo para proyectar la bioindustria española.
- Farmaindustria representa la gran industria farmacéutica con voz técnica y regulatoria ante la administración. Promueve la I+D en España y defiende un acceso basado en valor, innovación sostenible y retorno sanitario.
Ambas asociaciones son interlocutores clave para el despliegue de tecnologías emergentes como IA, datos clínicos en red o medicina personalizada a escala país.
🌍 España como plataforma europea de inversión e internacionalización
Los datos lo respaldan:
- España es el segundo país europeo en ensayos clínicos, sólo por detrás de Alemania.
- Más de 900 empresas biotecnológicas activas, con un volumen de negocio de 12.000 millones de euros (ASEBIO, 2023).
- Entornos como Barcelona Health Hub, MAD*Health, o Galicia Bio son ya referentes internacionales en inversión early-stage y transferencia tecnológica.
España tiene la oportunidad de consolidarse como hub biointeligente del sur de Europa, conectando biotecnología, ciencia de datos e industria farmacéutica bajo un modelo de innovación responsable, escalable y sostenible.
🔹 6. Conclusión: el futuro ya no es farmacéutico… es biointeligente
La industria farmacéutica ya no puede concebirse como una secuencia lineal de procesos: descubrimiento, validación, producción, mercado. Hoy, cada fase está interconectada, alimentada por datos, rediseñada por inteligencia artificial y exigida por un paciente que demanda eficacia, acceso y personalización.
La revolución no está en crear más moléculas, sino en entender mejor al paciente, al regulador, al sistema de salud y al ecosistema digital que rodea al medicamento.
El nuevo liderazgo farmacéutico no se define solo por patentes, sino por capacidad de adaptación, interoperabilidad y visión global basada en ciencia de datos.
La industria que viene será:
- Predictiva, no reactiva
- Colaborativa, no cerrada
- Biointeligente, no meramente farmacéutica
Y España —con su talento, su capacidad investigadora y su red de alianzas— tiene una oportunidad única para ser referente en este nuevo modelo.
En MAG Market Intelligence lo sabemos: no se trata solo de digitalizar procesos. Se trata de entender la IA como catalizador estratégico, y de acompañar a laboratorios, biotech e instituciones a liderar con rigor, ética y visión de futuro.
